醫療器(qì)械淨化解決方案及規範
1、GB50073-2013潔淨廠房設計規範
2、醫(yī)藥工業潔淨廠房設計規範 GB 50457-2008
3、體外診斷試(shì)劑生產實施細則(試行)
4、YY/T 1244-2014 體外診斷試劑(jì)用純化水
5、中國藥典GMP2015版純化水標準
6、《潔淨室施工及驗(yàn)收規範》GB50591-2010
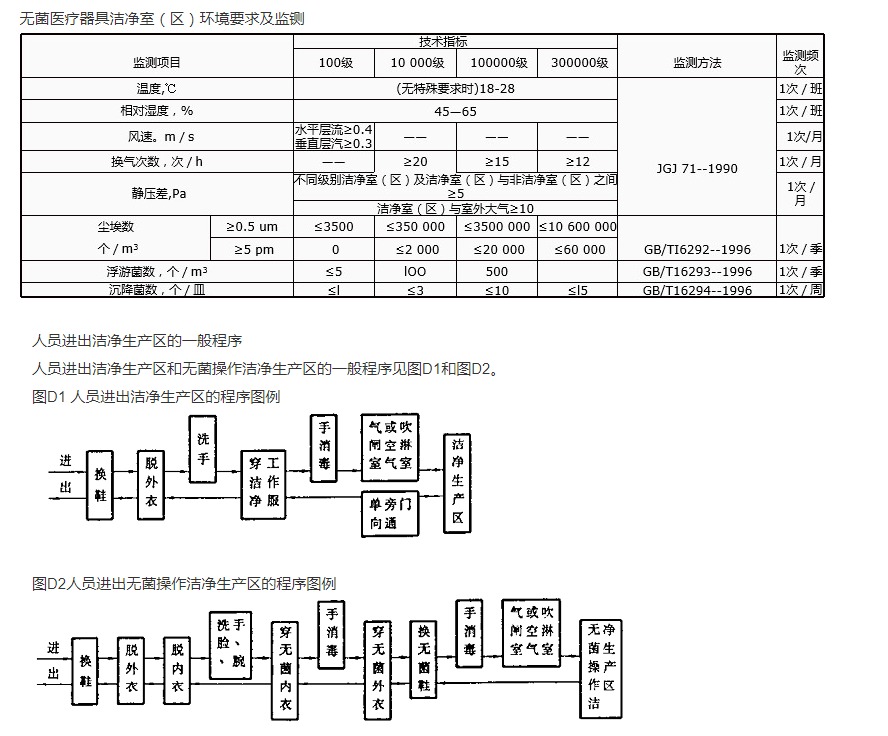
7、無菌醫療器具生產管理規範 - YY 0033-2000
醫療器械GMP車間解(jiě)決方案:
1、在生產或使用中活性物質、滅活物質的汙染(包括熱原)對產品產生重要影(yǐng)響的植入性醫療器械(xiè),醫療器械GMP車間規劃設計,應(yīng)對工(gōng)作環境進行控製,對滅活的方法應予驗(yàn)證(zhèng)並保(bǎo)存記錄。此類產品的生產和包裝應在有規範要求的、可控的環境下進行。
2、對非無菌植入性醫療(liáo)器械或使用前預(yù)期滅菌的醫療器械,如果通(tōng)過確認的產品清潔、包裝過程,能將汙染降低並保持一致的控(kòng)製水平(píng),醫療(liáo)器械GMP車間施工,應建立一個受控的環境來包含該確認的清潔和(hé)包裝過程。生產企(qǐ)業可參(cān)照YY0033-2000標準或自行驗(yàn)證並確定產品的生產潔淨級別。
3、應對受(shòu)汙染或(huò)易於汙染的產品進行控(kòng)製。應對受汙染或易於汙染的產品、工作(zuò)台麵或人員建立(lì)搬運、清潔和除汙(wū)染的文件。
醫療器械(xiè)GMP車間施工設計參考:
1、《醫療器械生產企業質量管理規範(試行)》,國家食品藥品監督管理局(2009年)--2015廢止。
2、《體外診斷試劑生產實(shí)施(shī)細則(試行)》,國家食(shí)品藥品監(jiān)督管理局(2007年)--2015廢止。
3、《關於實施(醫療器(qì)械生(shēng)產(chǎn)質(zhì)量管理規範(試行))及其配套文件有(yǒu)關問(wèn)題的(de)通知》(2011年)--2015廢止。
前麵1~3的(de)2007、2009年(nián)醫療器械的規範、細則、標準在2015年停用,醫療器(qì)械GMP車間規劃(huá),代之2015的(de)醫(yī)療器械生產企業質量(liàng)管理規範及(jí)無菌、植入、體外診斷試劑三個附錄。
4、醫藥工業潔淨廠房設計規範 GB 50457-2008
5、體外診斷試劑生產實施細(xì)則(試(shì)行)
6、YY/T 1244-2014 體外診(zhěn)斷試劑用(yòng)純化水
7、中國藥典GMP2015版純化水標準
8、《潔淨室施工及驗收規範》GB50591-2010
9、無菌醫療器具生(shēng)產管理規範 - YY 0033-2000
10、《潔淨廠房設計規範》(GB50073-2010)
11、《潔淨室施(shī)工及驗收(shōu)規(guī)範》(GB50591-2013)
12、《醫療產品的無菌加工第1部分:通用要求(qiú)》(YY/T0567.1-2005)
13、《無菌醫療器械生產與質量管理(lǐ)講義》,國家藥品(pǐn)監督管理局(2000)
為(wéi)確認A級潔淨區的(de)級別,每(měi)個采樣點的(de)采樣量不得少(shǎo)於1立方米。A級潔淨區空氣懸浮粒子的級別為ISO4.8,以≥5.0μm的懸浮粒子為限度(dù)標準。B級潔淨區(qū)(靜態)的空氣懸浮粒子的級別為ISO5,同時包括表中兩(liǎng)種粒(lì)徑的懸浮粒子。對於C級(jí)潔淨區(靜(jìng)態和(hé)動態)而言,空氣懸浮粒子的級(jí)別分別為ISO7和ISO8。對於D級潔淨區(靜態)空氣懸浮粒子的級別為ISO8。測試方法可參(cān)照ISO14644-1。
(2)在確認級別時,應當使用采樣管較短的(de)便攜式塵埃(āi)粒子計(jì)數器(qì),避免≥5.0μm懸浮粒子(zǐ)在遠程(chéng)采樣係統的長采樣管中沉(chén)降。在單向流係統中,應當采用(yòng)等動力學的(de)取樣頭。
(3)動態測試可在常規操作、培養基模擬灌裝過程中進行,證明達到動態(tài)的潔淨度級別,但培養基模擬灌裝試(shì)驗要求在“較差(chà)狀況”下進行動態測試。
根據相關規範要求(qiú),對無菌醫療(liáo)器械生產車間、藥品生產車間、醫學生物學實驗室、手(shǒu)術室等都要求建設符合相關標準的潔淨室。在潔淨室建設或改建時,不能依(yī)賴於較(jiào)終的竣工驗收來保證潔淨室的質量,必須從設計及設備選型(xíng)階段就嚴格(gé)把關(guān),在建設的全過(guò)程(chéng)中對主要關鍵點嚴格檢查、監督,在實際使用中定期(qī)監測才(cái)能(néng)保證潔淨室(shì)達到設計指標和使用要求。
無菌醫療器械是任何標明“無菌”的醫療器械,生產潔淨(jìng)室是保證無菌醫療(liáo)器械質量的基(jī)本條件,控製無菌醫療器(qì)械生產過程的環境並規範其生產,防止環境對無菌醫療器械汙染,潔淨室必須滿足規(guī)定環(huán)境參數的要求來建設和定期監測。
醫療器械淨(jìng)化工程建設中需考慮從以(yǐ)下問題:
1.醫(yī)療器械包裝車間潔淨室工程所需要的淨化材料;
2.醫療器械廠房(fáng)潔(jié)淨室及醫療器械包裝車間潔淨室工程的(de)設計、安裝、調(diào)試、維護等綜合服務;
3.醫療器械包裝車間潔淨(jìng)室工程空調淨化部分。
溫(wēn)度和相對濕(shī)度
無菌醫療器械在無(wú)特殊規定時,通常要求溫度在法規(guī)標準檢測StandardandTesting18~28C,濕度在45%~65%,企業一(yī)般都可以控製(zhì)在(zài)要求內。如(rú)在動態監(jiān)測中發現達不到要求(qiú),可(kě)能是室內有產熱大的儀器設備。
風(fēng)量、換氣次數、靜壓差(chà)
在潔淨室體積確定的情況下,換氣次數由該室的送風量決定,而靜壓差取決於房間的送風量(liàng)與(yǔ)回風量、排風量的差值。係統總(zǒng)送風(fēng)量、新風量、總排風量和對外壓差可(kě)以通過調整風機頻率轉速或總(zǒng)閥門開(kāi)啟度來實現,各房間的(de)風量和壓(yā)力則可通過調整分支管路閥門開度來現。
懸(xuán)浮粒子、浮遊菌、沉降菌
測試條件如不能滿足規定的環境參數(溫濕度、風速、換氣次數、靜壓差在規定範圍(wéi)之內)要求,關鍵項目懸浮粒子、浮遊菌或沉降菌的測試結果應視為無效。由於溫度、相對濕度、風速、換氣次數(shù)、靜壓差共同構成了潔淨室的(de)微氣候,是潔淨室維護正常與否的重要指征,可(kě)將關(guān)鍵工序關鍵項目測試(shì)修訂為關鍵工序全性能測試(shì)。隻有這樣,才(cái)能全麵、係統監測生產(chǎn)潔淨室,為確保潔淨室性能監測的數(shù)據科學性、準確性,測試部門在進行關(guān)鍵項目懸浮粒子、微生物(wù)測試時,應同時進行溫度、相(xiàng)對濕(shī)度、換氣次數、靜壓差等前提條件的測試。
溫度
潔淨室(shì)夏季室溫超過設計範圍的原因,多(duō)是由於開始確定的(de)各潔淨室的空(kōng)調送(sòng)風量即換(huàn)氣次數時隻注重滿足潔淨度指標,忽視了對各(gè)潔淨(jìng)室熱平衡的校核計(jì)算。因(yīn)此在(zài)生產潔(jié)淨室的設計及運行過程中,必須對潔淨室的(de)空調送風參數進行實時(shí)修正,保(bǎo)證各個(gè)季節生產潔淨室的溫度都維持18~28C。溫度和相對濕度主要影響產品生產工藝及細菌的繁殖條件,還能引發由生產操(cāo)作人員舒適度對產品質量的影響。
送風量、換氣次數(shù)
醫(yī)療器械淨化工程-無菌潔(jié)淨室(shì)工程設計階段對送風量的確定,首先要滿(mǎn)足相應潔淨度級別的換(huàn)氣次數要(yào)求,同時還要(yào)通過熱、濕負荷校核來進一步(bù)確(què)定風量,在此(cǐ)基礎上對高效過濾器進行選用。過濾器的處理風量應(yīng)小於或等於額定(dìng)風量,設置在同一潔淨區內的(de)高效(亞高效、超高效)空氣過濾器的阻力(lì)、效率宜(yí)接近。
醫療器械GMP車間管控總要求(qiú):
(1)表麵平滑;(2)表麵有(yǒu)耐(nài)磨性;(3)良好的熱絕緣性;(4)不易產生靜電;(5)不(bú)吸濕,不透濕;(6)吸聲性好;(7)容易加工;(8)表麵不易附著灰塵;(9)容易除去附著(zhe)的灰塵;



 昆明造實家具有限(xiàn)公司
昆明造實家具有限(xiàn)公司 0871-68391972
0871-68391972 807546425@qq.com
807546425@qq.com 13888322447
13888322447 昆明市五華區小普吉工業園88號
昆明市五華區小普吉工業園88號



